News

Industry News
中药和生物制品注册改革启幕!两意见稿透露未来风向
Source:医药网Release time:2017-11-02Click:1442次
医药网10月27日讯 10月23日,CFDA先后发布《药品注册管理办法(修订稿)》和《<中华人民共和国药品管理法>修正案(草案征求意见稿)》的征求意见稿,都是围绕10月1日中央办办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》提出36项重要改革措施做的修改。
其中,对临床研究审批“宽进严出”,明确药品的责任主体是药品上市许可持有人,对药品管理采取全链条和全生命周期管理,国内药品管理及注册逐步向国际靠拢等,都将进一步推动国内药企往国际化方向发展。
中药、生物制品新分类公布
哪些是未来申报热点?
《药品注册管理办法(修订稿)》公布了最新的生物制品和中药、天然药物的分类,分类方法与此前公布的化学药品分类方法基本相似,以创新药、改良药和仿制药进行分类,中药、天然药物单独设定了个新3类古代经典名方。生物制品分为预防用生物制品和治疗用生物制品。
备受关注的国际前沿的免疫细胞疗法如嵌合抗原受体T细胞(CAR-T)、自然杀伤细胞(natural killer cell,NK)和靶向活化自然杀伤细胞(taNK Cell)等,也有了申报类别——“申请人欲将细胞治疗类产品按药品进行注册上市的,可按治疗用生物制品相应类别要求进行申报。全新的基因治疗和细胞治疗类生物制品(例如创新机理、新载体、新靶细胞等),应当按照注册分类1类申报。在境内外已上市制品基础上进行改进的基因治疗和细胞治疗类生物制品,应当按照注册分类2类申报”。
生物制品的进口药分类与化学药品的进口药分类略有不同。化学药品将进口药根据原研还是仿制分为“5.1境外上市的原研药品(包括原料药及其制剂)申请在境内上市”和“5.2境外上市的非原研药品(包括原料药及其制剂)申请在境内上市”。生物制品则还是沿用创新药、改良药和仿制药分类方法:预防用生物制品的新5类“进口疫苗”分为“5.1新型疫苗”“5.2改良型疫苗”“5.3境外上市、境内未上市的疫苗”和“5.4境内已上市的疫苗”四类;治疗用生物制品的新5类分为“5.1新型生物制品”“5.2改良型生物制品”“5.3境外上市、境内未上市的生物制品”和“5.4境内已上市的生物制品”。
表1 新版化学药品,生物制品,中药、天然药物分类
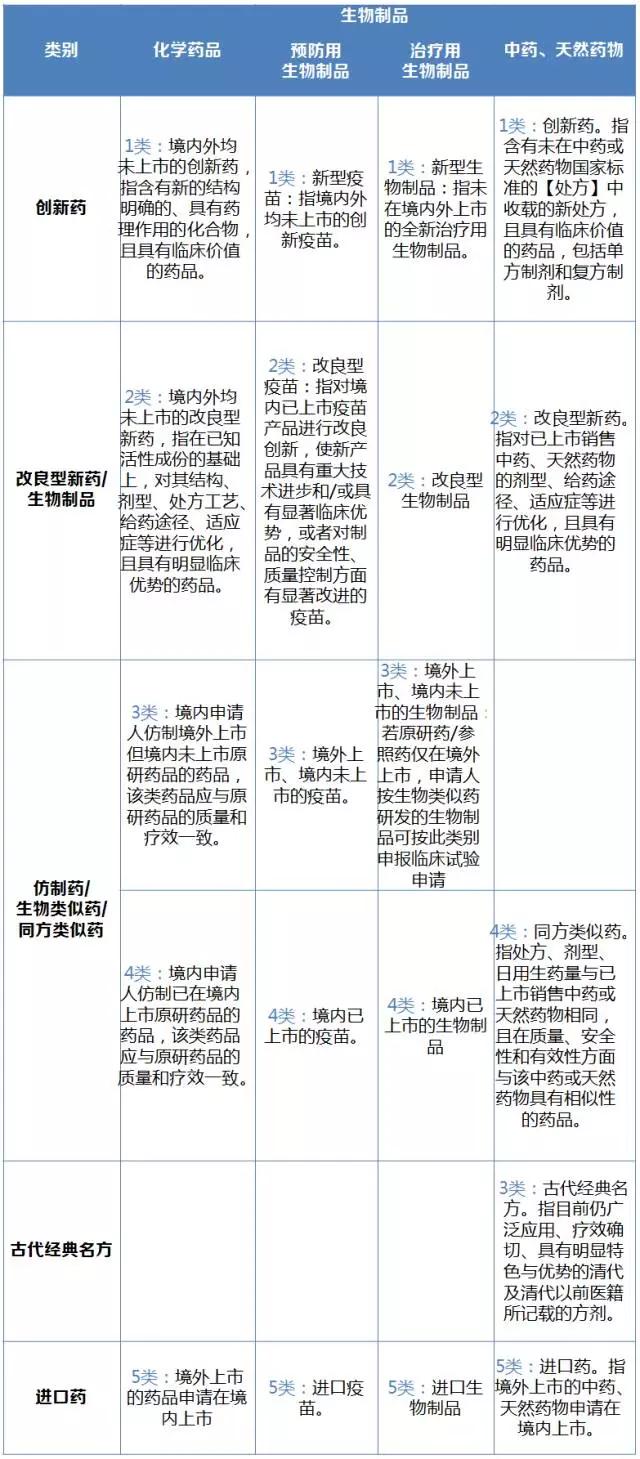
(数据来源:咸达数据V3.2)
创新药应当具有明确的临床价值;改良型新药应当比原品种具有明显的临床优势;仿制药应当与原研药品或参比制剂质量和疗效一致;生物类似药、同方类似药应当与原研药品或参照药品质量和疗效相当;来源于经典名方的中药复方制剂应当在处方、生产工艺、给药途径、功能主治等方面与传统应用保持一致。若以上药品分类满足不了对应的相关要求,将不予批准上市许可申请。
值得注意的是,在《中华人民共和国药品管理法》修正案草案征求意见稿中,删去“发给新药证书”的字眼。因而,新药证书对应的政策激励有可能取消,取而代之的可能是试验数据保护期。而有望获得激励的产品类别有创新药、罕见病治疗药品、儿童专用药、创新治疗用生物制品以及挑战专利成功的首仿药。改良型新药虽然属于新药,但在《药品注册管理办法(修订稿)》中并没有获得政策激励。
化学药品注册新分类方法执行以来,1类创新药、4类境内原研已上市仿制药和5类进口药是主要的申报热点。预计预防用生物制品中的1类新型疫苗和5类进口疫苗,治疗用生物制品中的1类新型生物制品、4类境内已上市的生物制品中的“4.1生物类似药”和5类进口生物制品,中药、天然药物的3类古代经典名方,将是未来的申报热点。
临床研究审批“宽进严出”、与国际接轨
试验数据管理将受重视
由于对第三章“药物临床试验”内容的细化,《药品注册管理办法(修订稿)》中药物临床试验出现频次共111次,相较于2007年版的仅出现27频次,可见新规对药物临床试验的重视。
临床研究审批进入“宽进严出”时代的“宽进”标志,除了已经开展的仿制药生物等效性试验备案制,还有就是药物临床试验的启动,从“收到临床批件才允许启动”改为“期限内默许启动”,国家药品监督管理部门依据相关法规和技术要求,对药物临床试验申请进行审评审批,药品审评机构60天内形成审评结论,未给出否定或质疑意见的,自受理之日起第61个工作日视为同意,申请人可按照提交的方案开展药物临床试验。
药物临床试验以往的批准模式是发给申请人临床批件。新规下药物临床试验申请视为同意的,申请人可以使用原始编号登录相关系统,自行打印许可文件启动药物临床试验;进口药品申请人凭打印的许可文件办理临床试验用药的进口通关。药品审评机构对药物临床试验申请不予批准的,发给申请人《审批意见通知件》,并说明理由。新规的改变将推动技术转让中合同内容的改变,许可文件的获得将是“临床批件获得”同阶段同性质的里程碑标志。
“严出”的标志就是2015年起已经在执行的临床自查核查,《药品注册管理办法(修订稿)》再一次强调了临床数据真实性的重要性——在注册管理过程中发现申报资料或备案信息不真实或者发现涉及真实性问题申请人无法做出合理解释的,药品审评机构可不再继续进行综合评估,作出直接不予批准结论。
此外,药品审评机构将对申请人提交的首次药物临床试验方案、后续药物临床试验方案和方案变更、药物临床试验期间的各类报告、沟通交流中提及的科学问题等进行审查,并且可以在药物临床试验过程中启动监督检查:若发现申请人未按要求及时报告非预期严重不良反应,或有证据证明试验药物受益风险比明显低于已批准药品,或发生非预期严重不良反应等且经评估威胁受试者安全,或存在药物临床试验弄虚作假等情形之一的,药品监督管理部门可采取暂停或终止药物临床试验的措施。以上政策都显示了CFDA对临床研究管理越来越注重过程管理,这也是“严出”管理的表现。
海外临床试验数据的认可、试验数据保护等政策,显示了我国正逐步与国际药政相接轨。享有保护待遇的“自行取得且未披露的试验数据”更多会是临床试验数据。在数据保护期的激励之下,药品上市许可持有人或生产企业将会越来越重视对临床试验数据的保护与管理。
思考<<<
首仿药竞争如何突围而出?
中国上市药品目录集制度(即“橙皮书”)在建,已上市药品信息将要公开,说明书的信息、审评结论及依据(剔除企业商业及技术秘密部分)也要公开了。
其中特别值得关注的是,进口药申请注册时,外文资料应当提交中文译本,中文译本的内容应当与外文资料一致,不一致的以中文译本为准。这意味着原研药进口中国成功上市后,一些基本的注册申报资料将被公开,并且是中文版的。国内仿制药企业都可以借鉴原研药的相关资料,资料关未来都不会是新4类化学药品的拦路虎。那么,能否生产与原研药质量一致的产品,备案制下如何提高临床试验管理效率,以及能否挑战专利成功,都是考验各家抢新4类首仿的核心关键点。
对于新3类首仿药,未来立项可以参考CFDA提供的《专利权到期、终止、无效尚且无仿制申请的药品清单》。2017年10月20日,CDE发布的关于征求《首批专利权到期、终止、无效尚且无仿制申请的药品清单》意见的通知中,公布了10个具有明确临床价值的国内化合物专利权到期、终止、无效且尚无仿制申请的国外已上市药品。咸达数据V3.2发现,此10个药品仅依鲁司他的原研厂家Genzyme Corporation在中国申报注册,其余药品都暂无国内外厂家申报,这或许和10个药品的适应症都比较“冷门”有关。
不考虑境外临床试验数据的可接受性对注册的影响,按《接受境外临床试验数据的技术要求(征求意见稿)》,“在境外开展仿制药研发,具备完整可评价临床试验与数据的,可用于在中国的药品注册申报”,这将会推动国内企业寻找海外的合作伙伴做进口仿制药的引进工作,对应的仿制药竞争加剧,最后难免会陷入成本竞争。海外引进产品的整体成本通常高于国内生产成本,未来可能选择建立合资企业在国内生产以降低成本。国内仿制药企业在立项前应对海外注册情况做分析,并且做好要打成本战的准备
Return

